Een pas ontwikkeld gereedschap om zenuwschade aan te tonen via bloedonderzoek. Een gloednieuwe behandeling die het TTR-gen in één behandeling definitief uitschakelt. Een manier om al aanwezig amyloïd af te breken lijkt veelbelovend bij meerdere types amyloïdose. De ontwikkelingen gaan razendsnel. “We zitten met amyloïdose in een spannende tijd,” vertelt Bouke Hazenberg, voormalig hoofd van het expertisecentrum in Groningen. En ja, er is dus goed nieuws.
Op het verslag van de conferentie in Madrid kwamen meerdere vragen binnen. Dr. Bouke Hazenberg, voormalig hoofd van het Expertisecentrum Amyloïdose, woonde het congres over ATTR-amyloïdose afgelopen november bij. Zijn verslag volgt hieronder, en hij beantwoordt een aantal vragen. De hoofdvraag: “Is er ook goed nieuws voor mensen met wild type ATTR of voor mensen met AL?”
Zenuwbetrokkenheid
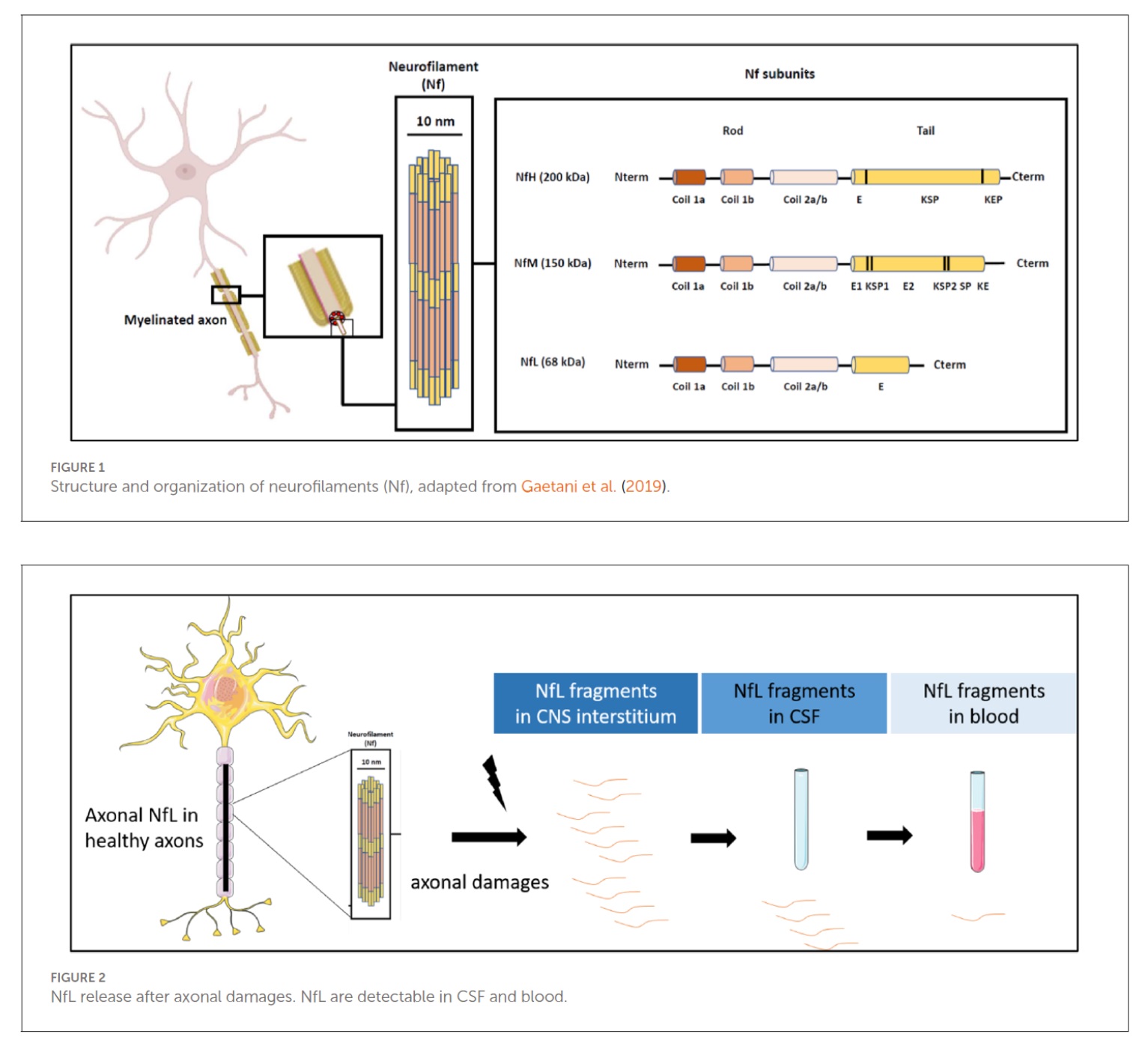
Bouke Hazenberg: “Een van de hoogtepunten tijdens het congres in Madrid was de lezing van Mary Reilly over neurofilament light chain. Zij vertelde over een nieuw gereedschap om via bloedtesten zenuwbetrokkenheid van amyloïdose tijdig te ontdekken en het beloop ervan te volgen. Met behulp van bloedtesten kan het functioneren van organen en weefsels al langer in kaart worden gebracht. Voor de nier zijn dat ureum en creatinine in het bloed en eiwit in de urine. Voor de lever zijn dat vooral alkalische fosfatase (AF), gamma-glutamyltransferase (GGT) en bilirubine. Voor het hart zijn het troponine en NT-proBNP.
Tot voor kort was er geen enkele test voor het functioneren van de zenuwen, daar is nu verandering in gekomen. Neurofilament light chain (NfL) is een eiwit dat alleen in zenuwcellen voorkomt en dat betrokken is bij het onderhoud en de opbouw van de zenuwcel (zie figuur 1). Zoals troponine in het bloed komt en daar in verhoogde concentratie gevonden kan worden bij schade aan hartcellen, zo komt bij schade aan zenuwcellen NfL in het bloed en kan daar in verhoogde concentratie worden gevonden. Regelmatige controle van het bloed van patiënten met amyloïdose helpt om een indruk te krijgen van het begin of beloop van nier-, lever-, hartschade. En nu dus ook van zenuwschade.
Het aardige was dat Milou Berends, student bij het expertisecentrum in Groningen, in een andere lezing resultaten uit Nederlandse centra mocht tonen die het nut van NfL voor het ontdekken en volgen van zenuwschade bevestigden.”
Knock-out als standaardbehandeling
“Een ander hoogtepunt tijdens het Madrileense congres was het werk (van medicijnenbedrijf Intellia) over manipulatie van DNA met behulp van CRISPR-Cas9 bij 60 patiënten.
Met deze nieuwe techniek (NTLA-2001) is het mogelijk om bij één toediening, het TTR-gen gericht en definitief uit te schakelen in het DNA van levercellen. De al langer toegepaste gene-silencers (gen-onderdrukkers), zoals patisiran, hebben een tijdelijk effect en moeten periodiek worden toegediend.
Met NTLA-2001 is het effect op TTR hetzelfde, maar nu definitief, zodat de lever nadien nauwelijks meer TTR produceert en de bloedspiegels ervan definitief laag blijven. Gesproken wordt daarom over gerichte knock-out van het TTR-gen. Intellia verwacht dat deze techniek in de nabije toekomst de standaardbehandeling kan worden voor zowel erfelijke ATTR-amyloïdose als verworven wild type ATTR-amyloïdose.”
Dus dat is ook goed nieuws voor patiënten met wild type ATTR!?
“Deze behandelingen werken ook bij wild-type ATTR amyloïdose. Maar bij het in de toekomst aanbieden van deze behandelingen aan de vele honderden, misschien wel duizenden, oudere mensen met wild-type ATTR-amyloïdose zullen vermoedelijk ook andere overwegingen meespelen: veiligheid op oudere leeftijd als de patiënt aan meerdere ziektes lijdt. En de kosten, in vergelijking met wat de behandeling oplevert aan extra kwalitatieve levensjaren.”
Ogen en hersenen
Denkt u dat de ziekte binnenkort te genezen is?
“Ja en nee. De verwachting is dat dankzij deze manipulatietechnieken van het DNA de amyloïdose in de zenuwen en het hart goed te behandelen zal worden. Dus ja, dat biedt in ieder geval een oplossing voor de huidige bulk van problemen. Maar amyloïd in de ogen en in de hersenen is niet het gevolg van TTR in het bloed vanuit de lever, maar van TTR afkomstig vanuit het netvlies en vanuit een bloedvaatkluwentje (plexus choreoïdus) dat middenin de hersenen zit en dat het hersenvocht produceert. Dus nee, oog- en hersenproblemen worden hiermee niet genezen.”
Lopen er al studies naar de behandeling van ogen en hersenen?
“Het lijkt erop dat tafamidis ook doordringt in het hersenvocht. Het is daarin teruggevonden, maar het is de vraag of de spiegels, bij een dagelijkse inname van 20 mg, in de hersens hoog genoeg worden om daar effectief te kunnen zijn. Of andere TTR-stabilisatoren zoals AG10 ook in het hersenvocht kunnen doordringen is, bij mijn weten, nu niet bekend. Studies of studieplannen met gen-onderdrukkers voor ogen of hersenen zijn mij evenmin bekend. Wat de ogen betreft is wel duidelijk welke problemen er kunnen optreden. Maar voor de hersenen moet er eerst meer duidelijkheid komen over de verschijnselen die als eerste kunnen optreden en hoe die het beste opgespoord en gevolgd kunnen worden. Te denken valt aan nucleair geneeskundig onderzoek, zoals ook bij de ziekte van Alzheimer gebruikt wordt.”
Voor oogproblemen zijn er toch operaties of is dat niet altijd mogelijk?
“Veel problemen met de ogen, zoals glasvocht troebelingen, kunnen goed door operatie aangepakt worden, maar dat moet vaak herhaald worden na een paar jaar, omdat het proces in de ogen doorgaat. En er zijn andere problemen met de ogen, zoals de bloedvaatjes van het netvlies, die niet geopereerd kunnen worden. Dus het blijft ook wachten op medicijnen voor de ogen die het proces tot stilstand kunnen brengen.”
Amyloïd opruimen
In hoeverre kan het amyloïd in andere organen worden opgeruimd?
“De perifere (buiten het centrale stelsel liggende) zenuwen en het hart zijn de belangrijkste weefsels/organen die door erfelijke ATTR-amyloïdose in de problemen komen. De nier is er zelden bij betrokken, lever en longen eigenlijk nooit. Problemen in het spijsverteringsstelsel berusten vooral op problemen van de zenuwen die de maag en darmen verzorgen en niet zozeer op aantasting van deze organen door amyloïd. Voor ogen en hersenen is het anders, zie hierboven. Dus of amyloïd uit andere organen verdwijnt wordt niet erg van belang geacht en ook niet onderzocht. Wel loopt er in Groningen een onderzoek of de verbetering die in hart, zenuwen en in het lichaam algemeen kan optreden, gepaard gaat met verbetering van de hoeveelheid amyloïd in het vetweefsel.”
DNA-techniek uitgelegd
Kunt u de DNA-techniek kort toelichten?
“Het is best een ingewikkelde techniek om uit te leggen. En er komen een hoop ingewikkelde termen in voor. De DNA-techniek borduurt voort op de al bestaande techniek van gen-onderdrukkers als patisiran. Ook die komen in de levercel terecht, maar remmen dan slechts een beperkte tijd de TTR-productie via interactie met RNA in plaats van met DNA.
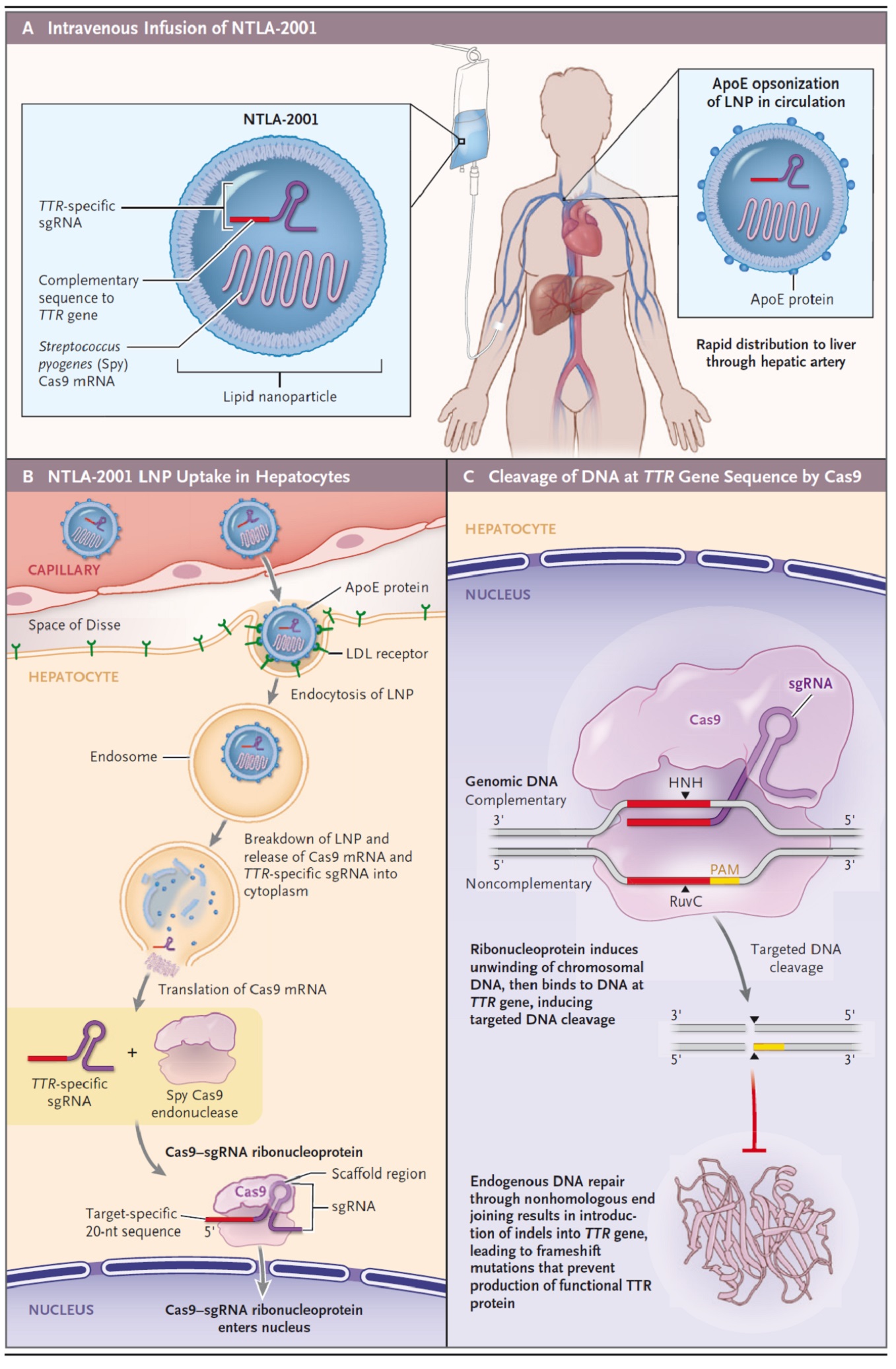
Bij de DNA-techniek van NTLA-2001 (zie figuur 2) zit in een minuscuul vetbolletje (een lipide Nano-partikel) zowel single guided RNA (sgRNA), dat exclusief de volgorde van het TTR-gen op het DNA herkent, als het Cas9 boodschapper-RNA. Het bolletje wordt via de bloedbaan toegediend en apolipoproteine E dat in het bloed zit, bindt zich aan het Nano-partikel. De levercellen herkennen apolipoproteine E via een receptor en halen het hele partikel de levercel binnen en omhullen het door een blaasje (een endosoom).
Het partikel bereikt de lever op dezelfde manier als de gen-onderdrukkers. Maar het Nano-partikel wordt vervolgens in het endosoom afgebroken, waarop het boodschapper-RNA van Cas9 vrijkomt in de levercel en vervolgens de levercel aanzet om het enzym Cas9 (een endonuclease) te maken. Dat voegt zich samen met het stukje RNA dat TTR herkent, tot een complex dat Cas9-sgRNA ribonucleoproteïne heet. Dat complex verplaatst zich vervolgens binnen de levercel naar de kern van de cel.
Het DNA, dat is gewikkeld om een soort klosjes (dat moet wel omdat het zo lang is dat het anders niet in de kern past), wordt door het ribonucleoproteïne iets afgewikkeld, waarbij het stukje met het TTR-gen tevoorschijn komt en afgelezen kan worden. Het stukje aan het sgRNA dat TTR herkent bindt zich aan het DNA, waarop het enzym Cas9 het DNA doormidden knipt en daarbij een klein stukje verwijdert zodat een gemankeerd TTR-gen overblijft dat niet meer afgelezen kan worden en er dus door die cel nooit meer TTR gemaakt kan worden.
Deze DNA-technieken werken voor alle mensen met (aanleg voor) ATTR-amyloïdose. De resultaten zijn goed, en de verwachtingen voor de toekomst zijn hoog.”
Meer baanbrekend onderzoek
Zijn er op het ogenblik nog andere (baanbrekende) onderzoeken gaande?
“Niet zozeer besproken in Madrid, maar wel baanbrekend dit jaar: afbraak van aanwezig amyloïd. De hoop is dat de komende jaren meer bekend wordt over mogelijke resultaten bij verschillende typen amyloïdose. Onlangs verscheen hierover een eerste artikel van Pablo Garcia-Pavia en anderen, waarin ze lieten zien dat een antilichaam tegen ATTR-amyloïdose (NI006) veilig gebruikt kan worden bij patiënten met hartbetrokkenheid. Vervolgstudies moeten aantonen hoe effectief antilichamen kunnen zijn bij het opruimen van al aanwezig amyloïd. Tot nu toe kon de behandeling slechts gericht worden op het tegengaan van de vorming van nieuw amyloïd. De verwachting dat het lichaam daarmee de kans kreeg om (in wisselende mate) het amyloïd op te ruimen, lijkt nu een nieuwe fase in te gaan, waarbij behandeling actief wordt ingezet om al bestaand amyloïd te bestrijden. De verwachtingen zijn hoog gespannen.”
AL-amyloïdose
“Ik denk dat de antilichamen bij alle typen amyloïdose een rol gaan spelen en dat voor andere erfelijke typen amyloïdose ook gen-onderdrukkers en DNA-manipulatie ontwikkeld zullen worden. Er zijn nieuwe geneesmiddelen die bij AL-amyloïdose kunnen helpen. Er gebeurt te veel om even op te noemen, en ik verwacht dat op de bijeenkomst in juli (in Brussel) weer nieuwe ontwikkelingen over AL- amyloïdose gebracht zullen worden. En dit geldt voor alle typen amyloïdose tijdens het symposium dat dit voorjaar in Rochester in de Verenigde Staten wordt gehouden. We zitten op dit moment met amyloïdose in een zeer dynamische tijd.”